Mit der CRISPR/Cas-Methode lässt sich das Genom von Menschen, Tieren, Pflanzen, Mikroorganismen gezielt verändern. Für ihre Entwicklung gibt es sogar den diesjährigen Chemie-Nobelpreis. Doch die „Genschere“ bringt ungelöste Fragen mit sich, vor deren Beantwortung sich sogar eine internationale Kommission drückt. Wolfgang Nellen, emeritierter Professor für Genetik an der Universität Kassel und Gründer des Öffentlichkeitslabors Science Bridge, erklärt für 1E9, worum es dabei geht.
Ein Gastbeitrag von Professor Dr. Wolfgang Nellen
Es übersteigt wahrscheinlich die Vorstellungskraft der meisten Menschen, was die Entdeckung und Entwicklung des CRISPR-Cas-Systems in den letzten Jahren an Anwendungen der Gentechnik möglich macht. Mit CRISPR-Cas können punktgenau Veränderungen in jedem beliebigen Genom, einschließlich dem des Menschen vorgenommen werden. In der Forschung ist die Methode zur Routine geworden.
Bei Pflanzen, Tieren und Mikroorganismen werden fast täglich neue Ideen ausprobiert. Da gibt es Ölsaaten mit gesünderen Fettsäuren. Krankheitserreger, die gezielt geschwächt werden, um als Impfstoffe zu dienen. Schweine, die in Zukunft als Organspender fungieren könnten. Und vieles mehr. In der Landwirtschaft sind einige Produkte sogar schon auf dem Markt. Beim Menschen gab es Ende 2018, Anfang 2019 einen kurzen Hype, als der chinesische Wissenschaftler He Jiankui die Geburt von zwei Mädchen verkündete, die er mit CRISPR-Cas immun gegen HIV machen wollte. Der Fall sorgte für einen weltweiten Aufschrei.
Denn in der Medizin sind lediglich somatische Eingriffe in das menschliche Erbgut inzwischen weitgehend akzeptiert – also Eingriffe, die das Genom von Körperzellen eines bereits geborenen Menschen betreffen. Einige derartige Anwendungen werden bereits erfolgreich klinisch erprobt. Dabei handelt es sich hauptsächlich um die Behandlung von Blutkrankheiten wie der Sichelzellkrankheit. Aber auch angeborene Blindheit wird in ersten Experimenten direkt im Auge therapiert. Bei somatischer Therapie geht es also um die Reparatur eines mutierten Gens in bestimmten Organen. Und wenn alles richtig funktioniert, wird der Patient zwar geheilt, eine Vererbung des reparierten Gens auf seine Nachkommen findet jedoch nicht statt.
Eingriffe in die Keimbahn sind (noch) zu riskant
Bei der Keimbahntherapie dagegen wird in der Regel das Genom schon in befruchteten Eizellen, den Zygoten, repariert. Eine Erbkrankheit könnte dadurch schon vor der Geburt eliminiert werden und auch die Nachkommen wären nicht mehr betroffen. Um so einen Eingriff hat es sich wohl bei den chinesischen Mädchen gehandelt.
Und zunächst hört sich auch das gut an. Derartige Eingriffe bedeuten aber auch Risiken und die wissenschaftliche Community ist sich weitgehend einig, dass die Entwicklung noch (!) nicht weit genug ist, um eine Keimbahntherapien verantwortungsvoll durchführen zu können. Allerdings schreitet die Forschung rasend schnell voran: Die Methodik wird ständig optimiert und ein Papier über den „aktuellen Stand“ ist bereits veraltet, wenn es gedruckt wird.
Es ist deshalb nicht nur sinnvoll, sondern dringend nötig, sich vorausschauend Gedanken zu machen: Welche Eingriffe sind denkbar? Welche sind ethisch vertretbar und welche nicht? Wo liegen zurzeit (!) die technischen Grenzen und wo besteht Forschungsbedarf? Wo gibt es juristische Grauzonen? Man kann einen Embryo schließlich nicht fragen, ob er mit einem gentechnischen Eingriff einverstanden ist.
Unter dem Titel International Commission on the Clinical Use of Human Germline Genome Editing hat sich nun eine illustre Kommission wissenschaftlicher Akademien aus vielen verschiedenen Ländern zusammengesetzt und einen Report geschrieben. Er fasst die technischen und ethischen Anforderungen an potenzielle genetische Eingriffe in die menschliche Keimbahn zusammen.
Die Kommission drückt sich vor unbequemen Fragen
Die Kommission stellt darin zunächst fest, dass (zurzeit) Keimbahneingriffe nur in Frage kommen (sollten), wenn eine Krankheit lebensbedrohlich ist oder zu schweren Einschränkungen und Leiden führt. Zusätzlich muss sie eine hohe Penetranz haben, das heißt die Wahrscheinlichkeit, dass der Gendefekt tatsächlich zu der Erkrankung führt, muss hoch sein.
Das ist etwa bei Mutationen im BRCA-1- oder 2-Gen, die zu Brustkrebs führen können, nicht der Fall. Personen mit dieser Mutation bekommen nicht unbedingt Brustkrebs, Die Mutation hat eine relativ geringe Penetranz. Im Gegensatz dazu führt eine bestimmte Mutation auf Chromosom 15 immer zum Tay-Sachs Syndrom, einer schweren Erkrankung, die in der Regel zum Tod im Alter von drei Jahren führt. Die Mutation hat eine hohe Penetranz.
Diese Zusammenfassung durch die Kommission ist ein lobenswertes Unterfangen! Im Grunde kann man (fast) allen Vorschlägen und Überlegungen zustimmen. Aber: Knapp daneben ist auch vorbei! Denn der Report bringt auf über 200 Seiten wenig Neues und versäumt es, Probleme dezidiert anzusprechen und ethische Fragen zukünftiger, ganz offensichtlicher Anwendungen zu thematisieren. Zumindest einige dieser Probleme sollen hier behandelt werden.
Gentechnik-Tourismus
Die Kommission fordert allgemein gültige ethische Regeln für Genom-Editierung der menschlichen Keimbahn. Angesichts unterschiedlicher kultureller und nationaler Sichtweisen räumt sie jedoch ein, dass konkrete gesetzliche Vorgaben von den nationalen Gesetzgebern definiert werden müssen. Das ist zweifellos richtig, denn ethische Vorstellungen sind oft divergenter als wir uns das wünschen würden. Die Problematik ist mit nationalen Regeln jedoch nicht gelöst. Im Gegenteil, sie wird eher verschärft.
In einer globalisierten Welt könnte jeder, der über ausreichende finanzielle Mittel verfügt, das Land aufsuchen, in dem ein gewünschter Eingriff erlaubt ist. Es ist sogar zu erwarten, dass einige Länder ihre Regeln speziell für einen – voraussichtlich sehr lukrativen – „Editierungs-Tourismus“ zusammenstellen. Restriktivere nationale Regeln verlieren damit an Wirkkraft. Die Zwei-Klassen-Gesellschaft würde durch Editierungs-Tourismus verstärkt und unter Umständen sogar genetisch verankert werden (siehe unten: Enhancement). Es ist schwierig, vielleicht sogar unmöglich, dieses Problem zu lösen. Es sollte jedoch offen diskutiert werden.
Extrem seltene Einsatzmöglichkeiten bei monogenen Krankheiten
Wesentliche Teile des Reports befassen sich mit Krankheiten, die durch ein einziges mutiertes Gen hervorgerufen werden, sogenannte monogene Erkrankungen. Nach Ansicht der Kommission kommen diese am ehesten für Editierungen in der Keimbahn in Frage. Dabei wird nicht unterschlagen, dass auch bei diesen Krankheiten nur in seltenen Situationen ein gentechnischer Eingriff überhaupt sinnvoll ist. Ich möchte ergänzen, dass es sich um sehr seltene Situationen oder besser sehr, sehr, sehr seltene Situationen handelt.
Der Grund dafür ist die uralte Mendel-Genetik. In den allermeisten Fällen hat ein von einer Krankheit betroffenes Paar mindestens eine 25-prozentige Chance ein gesundes Kind zu zeugen. Durch in-vitro Befruchtung und genetische Testung vor der Implantation in die Gebärmutter kann ein gesunder Embryo ausgewählt werden. Das Risiko und die Belastung der Frau sind deutlich geringer als bei einem gentechnischen Eingriff.
Davon gibt es allerdings ein paar Ausnahmen. Wenn ein Partner sowohl vom Vater als auch von der Mutter eine dominante Mutation eines krankmachenden Gens geerbt hat, werden alle Nachkommen die Krankheit haben. Es gibt aber verschwindend wenig Fälle, bei denen eine Person mit zwei dominanten Mutationen, die jede für sich allein eine schwere Krankheit verursachen, überhaupt lebensfähig ist – und später Vater oder Mutter werden kann. Um das Problem zu veranschaulichen, führen wir zwei Grafiken ein, die manche vielleicht an den Biologieunterricht erinnern.
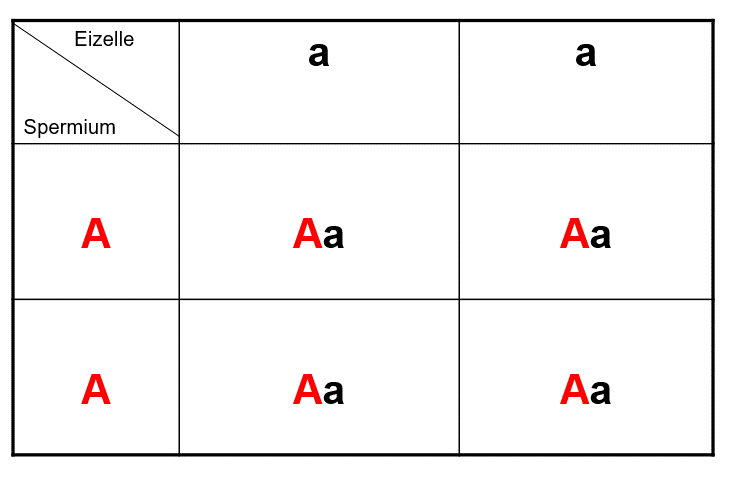
In diesem Fall hat der Vater zwei mutierte Genvarianten (A), die beide die Krankheit verursachen (rot). Er kann deshalb nur Spermien produzieren, die das defekte Gen enthalten. Das Gen ist dominant (deshalb als Großbuchstabe dargestellt). Das heißt, dass bereits eine Kopie ausreicht, um krank zu sein. Die Mutter ist gesund. Sie hat zwei normale Varianten des Gens (schwarz), die aber der mutierten Form „unterlegen“ (rezessiv) sind (deshalb als Kleinbuchstabe dargestellt). Die Mutter produziert nur „gesunde“ Eizellen, trotzdem haben alle Kinder vom Vater das „überlegene“ mutierte Gen und sind krank. In den meisten Fällen ist aber eine Person mit zwei dominanten mutanten Genen gar nicht lebensfähig. Diese Situation ist also sehr selten.
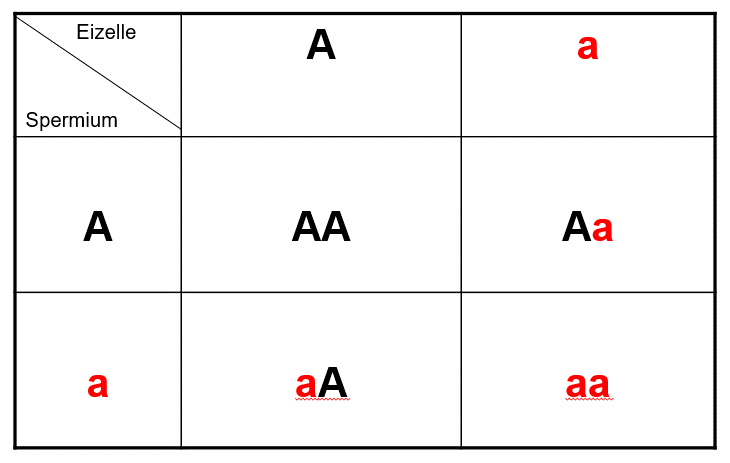
In diesem Fall sind beide Eltern gesund. Sie tragen aber eine Kopie des mutierten Gens (rot) das jedoch dem normalen Gen (schwarz) „unterlegen“ ist. Beide Eltern produzieren zwei Arten von Spermien bzw. Eizellen, solche mit dem mutierten und solche mit dem normalen Gen. Für einen Embryo sind die vier gezeigten Kombinationen möglich. Ein Kind mit der Kombination aa ist krank, obwohl beide Eltern gesund sind! Ein Kind mit der Kombination Aa ist gesund, trägt aber das mutierte Gen und kann, je nach Partner, kranke Kinder zeugen. Ein Kind mit der Kombination AA ist völlig gesund und kann die Krankheit auch nicht auf seine Nachkommen weitergeben. Obwohl beide Partner eine mutierte Genkopie tragen, liegt die Wahrscheinlichkeit für ein gesundes Kind bei 75 Prozent. In einer pränatalen Diagnostik (oder Präimplantationsdiagnostik) würde man Embryonen mit der Kombination aa aussortieren, alle anderen Kinder wären von der Krankheit nicht beeinträchtigt. Will man allerdings versuchen, die Krankheit komplett auszurotten, würde man auch Aa-Embryonen verwerfen.
Eine weitere Ausnahme kann – muss aber nicht! – auftreten, wenn beide Partner von der Krankheit betroffen sind. Das ist statistisch eher sehr unwahrscheinlich, kommt aber durchaus vor. In manchen Fällen fühlen sich Personen mit derselben Krankheit voneinander angezogen und es treten häufiger Paare auf, bei denen beide betroffen sind. Das bekannteste Beispiel ist erbliche Taubheit. Hier wird aber häufig die Krankheit von den Betroffenen gar nicht als Krankheit empfunden – auch nicht, wenn ein Paar ein gehörloses Kind bekommt.
Es bleibt also nur ein verschwindend geringer Teil der Weltbevölkerung, für den ein Keimbahneingriff überhaupt sinnvoll wäre. Materialistisch gedacht kommt hinzu, für wen aus diesem verschwindend geringen Anteil dann die medizinische und wissenschaftliche Infrastruktur sowie die erforderlichen finanziellen Mittel überhaupt zur Verfügung stehen.
Will man sich also wirklich auf Eingriffe zur Bekämpfung monogener Krankheiten beschränken, bleibt unterm Strich die Suche nach einer „Nadel im Heuhaufen“. Und für die müsste auch noch ein umfassendes globales Regelwerk geschaffen werden, das noch dazu keine Aussichten auf Einheitlichkeit hat.
Polygene Krankheiten sind zu komplex
Bei polygenen Krankheiten, also Krankheiten, die durch mehrere mutierte Gene verursacht werden, weist die Kommission mit Recht darauf hin, dass unser Wissen über genetische Netzwerke bisher zu gering ist, um erfolgversprechende Eingriffe zu erlauben. Aus Genome Wide Association Studies, kurz: GWAS, kennt man erbliche Komponenten, die mit bestimmten Krankheiten korrelieren. Das sind meistens sehr viele, bei Schizophrenie findet man beispielsweise mehr als 100 genetische Varianten, von denen jede aber nur einen sehr geringen Beitrag zu der Krankheit leistet und wohl meistens auch im Zusammenspiel mit Umweltfaktoren wirkt.
Alle diese Gene mit Genomeditierung auf „normal“ zu setzen, wäre ein gigantisches Unterfangen mit großen Risiken und ungewissem Ausgang. Zurzeit ist die Verhinderung polygener Erkrankungen daher illusorisch – aber wer weiß, wie sich die Wissenschaft entwickelt? Wäre es vielleicht in Zukunft gerade bei polygenen Erkrankungen sinnvoll, einzelne Risikogene zu „reparieren“, um eventuelle Erkrankungen zu minimieren.
Genetische Optimierung von Menschen
Der Report erwähnt eher am Rande die Möglichkeiten der „genetischen Optimierung“. Damit ist gemeint, in eine befruchtete Eizelle Genvarianten einzubringen, die nicht in den Eltern vorliegen. Das können beispielsweise Gene sein, die vor einer Infektionskrankheit schützen. Oftmals treten solche Gene nur sehr selten oder nur in bestimmten Populationen auf.
Die Sauerstoffaufnahme des Blutes und der Muskelaufbau könnten etwa durch Veränderungen des Erythropoetin- bzw. des Myostatingens „optimiert“ werden. Dafür sprechen Genvarianten bei den Sherpa im Himalaya, die einer bessere Sauerstoffnutzung erlauben. Bei Arnold Schwarzenegger wird wiederum vermutet, dass sein Körperbau etwas mit einem veränderten Myostatingen zu tun hat. Etwas futuristischer, aber durchaus denkbar wäre auch eine „Strahlungsresistenz“ für zukünftige Raumfahrer oder eine Erweiterung der sichtbaren Wellenlängen in den infraroten oder ultravioletten Bereich. Das ist jedoch nur die Spitze des Eisbergs.
Mit genomweiten Assoziationsstudien, den GWAS, wird seit etlichen Jahren die genetische Grundlage komplexer menschlicher Eigenschaften erforscht. Ein Hauptaugenmerk liegt dabei auf der sogenannten „Intelligenz“. Und man wird fündig! Etwa 1.000 Genvarianten wurden identifiziert, die jeweils einen kleinen Beitrag dazu leisten, wie „klug“ ein Mensch ist. Wenn man sich auf Subtypen der Intelligenz konzentriert, zum Beispiel mathematische oder musische Intelligenz, Kombinatorik, Gedächtnis, Sozialverhalten, wird die Zahl der Kandidatengene gewiss kleiner und ihr Beitrag größer.
Bisher handelt es sich bei den Ergebnissen meist zwar nur um Korrelationen. Aber etliche der gefundenen Gene „machen Sinn“, weil sie in entsprechenden Hirnregionen aktiv sind oder an der Regulation von Hormonen beteiligt sind, die bei der untersuchten Eigenschaft eine Rolle spielen.
Es ist meines Erachtens offensichtlich, dass solche „Optimierungen“ in Zukunft eine größere Rolle spielen könnten als der Versuch, genetisch bedingte Krankheiten „auszurotten“. Mehr oder weniger offen wird an solchen Projekten gearbeitet. Das amerikanische militärische Forschungslabor DARPA spekuliert schon öffentlich über „strahlungsresistente“ Astronauten.
Es ist etwas bedauerlich, dass die Kommission diesen Aspekt der Genomeditierung sehr stiefmütterlich und mit wenig Blick in die Zukunft behandelt. Optimierungen würden direkt eine der wesentlichen Forderungen des Reports berühren: Durch gentechnische Eingriffe dürfen keine Menschen diskriminiert oder bevorteilt werden. Optimierungen würden jedoch – wenn sie denn effektiv sind –, einen erblichen (!) Vorteil bringen und damit eine weitere Spaltung der Gesellschaft in genetisch mehr oder weniger bevorzugte Populationen.
Monitoring gentechnisch veränderter Menschen
Die Kommission geht ausführlich darauf ein, dass genomeditierte Menschen praktisch ihr Leben lang einem Monitoring unterliegen sollten – bis in die nächste Generation oder gar darüber hinaus. Die Belastung für die Patienten – inklusive der Medienaufmerksamkeit – könnte gravierend sein. Ob die notwendigen Daten überhaupt unvoreingenommen erhoben werden können, ist unklar. Von den Daten hängt jedoch die ganze weitere Verfolgung von Editierungsprojekten ab.
Der Report spricht die Probleme an, er geht jedoch nicht darauf ein, dass mit größter Wahrscheinlichkeit bereits Daten vorliegen. Vermutlich werden diese ausgeklammert, weil sie in ein ethisches Dilemma führen: Das Experiment des Chinesen He Jiankui wurde weltweit als wissenschaftlich und ethisch inakzeptabel verurteilt. Die Publikation der Ergebnisse wurde unterbunden, weil sie nicht die ethischen Standards der entsprechenden Journale erfüllten. Man befürchtet möglicherweise, ethische Standards ad absurdum zu führen, wenn man die Daten dennoch auswertet.
Andererseits existieren drei Kinder, die – unbeabsichtigt – Informationen liefern könnten, die nach guter wissenschaftlicher und ethischer Praxis niemals zu erhalten wären. Zumindest bei der Geburt waren die Kinder nach Angabe von He Jiankui und der chinesischen Presseagentur gesund und unauffällig, obwohl vermutlich etliche der Fehler aufgetreten sind, vor denen der Report warnt und die genau untersucht werden sollten:
- die Editierung verlief nicht wie beabsichtigt,
- in den Kindern liegen vermutlich unterschiedliche Editierungsmuster vor,
- mindestens eins der Kinder trägt eine editierte und eine nicht editierte Genkopie in einer Zelle, das heißt, es ist heterozygot für die Editierung,
- mindestens eines der Zwillingsmädchen ist ein Mosaik, das bedeutet, dass es aus unterschiedlichen Zellen besteht: editierten und nicht editierten,
- es ist unwahrscheinlich, dass die Embryonen mit größter Sorgfalt auf Off-Target-Effekte untersucht wurden – also unbeabsichtigte Folgen des Eingriffs.
Das Dilemma wird kaum lösbar sein. Darf man die existierenden, nicht wiederholbaren Informationen einfach ignorieren? Allem Anschein nach bemüht sich die chinesische Regierung darum, die Kinder (offiziell) zu vergessen.
Wie definieren wir Sicherheit?
Der Report besteht immer wieder darauf, dass die „höchstmögliche Sicherheit“ gegeben sein muss. Wie diese Sicherheit zu definieren ist, wird aber nicht angesprochen. Eine zuverlässige Sequenzierung des ganzen Genoms ist in frühen Embryonalstadien kaum möglich, um alle Off-Target-Effekte zu finden. In späteren Stadien ist es noch immer schwierig und aufwändig. Zudem kann es schwerfallen, natürliche Mutationen, von denen es etwa 70 in jedem Embyro gibt, von Effekten zu unterscheiden, die durch die Editierung entstanden sind.
Mosaike können, aber müssen nicht unerwünschte, negative Effekte für den Embryo haben. Wir wissen jedoch nicht mit Sicherheit, wie viele Mosaike bereits natürlich im Embryo entstehen. Ausgewachsene Menschen sind mit Sicherheit Mosaike, allein weil die Mutationsrate deutlich höher ist als die Zahl der Zellen in einem menschlichen Körper. Untersuchungen haben gezeigt, dass in jedem beliebigen Gewebe eine große Variabilität im Genom einzelner Zellen vorliegt. Welche Standards soll man nun setzen, um Mosaikbildung bei Embryonen zu vermeiden? Würde man möglicherweise eine große Zahl vom Embryonen verwerfen, die auf natürliche Weise ein Mosaik gebildet haben? Vielleicht hat Mosaikbildung sogar Vorteile?
Die vorgeschlagenen Sicherheitsstandards sind, mangels zuverlässiger Daten, sehr wenig konkret. Möglicherweise wird eine Sicherheit gefordert, die höher liegt als die der natürlichen Fehlerhäufigkeit.
Werde jetzt Mitglied von 1E9!
Als Mitglied unterstützt Du unabhängigen, zukunftsgerichteten Tech-Journalismus, der für und mit einer Community aus Idealisten, Gründerinnen, Nerds, Wissenschaftlerinnen und Kreativen entsteht. Außerdem erhältst Du vollen Zugang zur 1E9-Community, exklusive Newsletter und kannst bei 1E9-Events dabei sein. Schon ab 3 Euro (+ MwSt) im Monat!
Jetzt Mitglied werden!
Die Einbeziehung der Zivilgesellschaft und der Öffentlichkeit
Die Kommission kommt zum Schluss, dass es vor einer Genomeditierung in der menschlichen Keimbahn einer gesellschaftlichen Debatte bedarf. Das ist unbestritten. Dabei muss jedoch auch berücksichtigt werden, dass eine sehr kleine Zahl an Betroffenen einer überwältigenden Mehrheit an nicht Betroffenen gegenübersteht.
Gerade in Deutschland lässt der stark ideologisch geprägte Widerstand gegen die Gentechnik befürchten, dass der Minderheitenschutz von Menschen, die von einer erblichen Krankheit betroffen sind, nicht realisierbar wird. Auch die Wissenschaft stellt eine winzige Minderheit dar, die zudem keine einheitlichen Schlussfolgerungen ziehen wird – ein intrinsisches Charakteristikum der Wissenschaft, das auch sinnvoll ist. Wer letztlich die Entscheidungen trifft, wird von den jeweiligen Ländern bestimmt. Ob das „gerecht“ oder gar global konsistent erfolgt, ist eher unwahrscheinlich.
Was tun?
Erkenntnisse können nicht rückgängig gemacht werden. Man wird Genomeditierung ebenso wenig verbieten können wie das Rad – schon gar nicht in einer globalisierten Welt.
Wenn technisch fortgeschrittene Länder eine „Vorreiterrolle“ spielen wollen und die Technologie verbieten, entziehen sie sich der Verantwortung. Sie sind viel mehr gefordert, ihr Wissen und ihre Möglichkeiten einzusetzen, um Genomeditierung so sicher wie möglich zu machen. Nur sie können mit der größtmöglichen Zuverlässigkeit eventuelle Risiken identifizieren und auf Gefahren hinweisen, wenn ihre wissenschaftliche Kompetenz international anerkannt wird. Das kann erfolgreich sein und auch unterschiedliche ethische, kulturelle und politische Konzepte überwinden, an denen eine ethisch-moralische Kompetenz sehr leicht scheitern kann. Die Regulierungen, die die Kommission vorschlägt, sind gewiss sinnvoll und sie müssen versucht werden – ob sie international greifen, ist eine andere Frage.
Wir befinden uns in einer sehr spannenden Zeit: Erstmals kann die Menschheit voraussichtlich aktiv in ihre eigene Evolution eingreifen – und sich im schlimmsten Falle selbst auslöschen. Aber ich bin optimistisch. Die Entwicklung wird, weil sie noch aufwändig ist, langsam voranschreiten. Eventuelle Kollateralschäden werden sich deshalb in Grenzen halten. Das wird den Fortschritt kaum stoppen, aber hoffentlich in sicherere und ethisch vertretbare Bahnen lenken.
Die Armeen von Klonkriegern müssen wir nicht befürchten. Nicht etwa, weil sie nicht machbar, sondern weil sie nicht zweckdienlich wären.


 .
.